 |
 |
 |
+7 (812) 755-81-49 +7 (812) 946-37-01 |
|
Главная Пожарное вооружение 0 1 2 3 [ 4 ] 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 Установлено, что атомы металлов в зернах занимают строго определенные места, образуя элементарные ячейки так называемой пространственной (объемной) кристаллической решетки. В «узлах» металлической решетки находятся не атомы в чистом виде, а положительные ионы металлов, окруженные электронами. Эти обобщенные электронб! более или менее свободно перемещаются между ионами, не теряя в то же время связи с ними; поэтому выйти за пределы решетки при обычных условиях они не могут. Их называют полусвободными электронами, или «электронным газом». Отсюда и типичные для металлов свойства: электро- и теплопроводность, способность отражать световые лучи (отсюда блеск металлов) и радиоволны (на чем основана радиолокация), серовато-серебристый (у некоторых золотистый) цвет, пластичность, ковкость, механическая прочность. Пары металла состоят из одноатомных молекул, связанных друг с другом только слабыми силами межмолекулярного взаимодействия. Поэтому пары металлов не обладают электропроводностью, невелика их теплопроводность. Элементарные ячейки могут быть различного типа, что определяется химической природой или состоянием данного металла. Атомы таких металлов, как железо (при температуре ниже 910°С), хром, молибден, вольфрам, располагаются по углам кубика элементарной ячейки и один атом располагается в центре этой ячейки; общее число атомов, образующих ячейку, равняется 9. Такая ячейка (центрированный куб) является элементарным кристаллом, из очень большого числа которых и состоят все кристаллические зерна этих металлов (рис. 5,а). 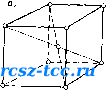 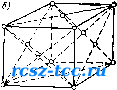 Рис. 5. Виды кристаллт1е-ских решеток металличежнх сплавов Если железо нагреть до температуры выше 910°С, в элементарных ячейках железа произойдет перестановка (перестройка) атомов: атомы расположатся по углам куба и в центре каждой его грани (куб с центрированными гранями). Число атомов в каждой элементарной ячейке железа при нагревании его выше 910°С увеличивается с 9 до 14, и объем кубика, образуемого атомами, значительно возрастает (рис. 5,6). Аналогичное расположение атомов наблюдается в кристаллических зернах ряда металлов: алюминия, меди, никеля. У цинка, магния и титана атомы внутри зерен образуют элементарные ячейки в форме шестигранной призмы. В этих кристаллах 12 атомов располага1ртся по углам двух Н1естиугольпых оснований призмы, два атома- в центре этих оснований, три атома - внутри нее. Такое расположение атомов в элементарных ячейках цинка, магния и других металлов образует так называемую гексагональную ([нестиграпную) элементарную ячейку пространственной решетки. Если отполировать, а затем протравить кислотой поверхность металлического изделия, можно обнаружить, что металл имеет не строго кристаллическую структуру, а зернистую с зернами-кристаллами неправильной формы. Неправильная форма отдельных металлических зерен объясняется образованием и ростом кристаллов при затвердении жидкого металла. При переходе металла из жидкого состояния в твердое первоначально образуются мелкие кристаллики - зародыши, или центры кристаллизации. .Пока они растут свободно, их геометрическая форма является правильной, строго кристаллической. Однако как только растущие кристаллы начнут соприкасаться друг с другом, правильность их формы нарушается. В месте соприкосновения кристаллов рост отдельных их граней прекращается. В результате развиваются не все, а только некоторые грани кристаллов. Кристаллы начинают теснить друг друга. В затвердевшем металле они соприкасаются друг с другом по различным границам. Сплавы металлов также имеют кристаллическое строение, однако их структура сложнее структуры однородного металла, так как сплав состоит из нескольких металлов - компонентов (составляющих). Когда сплав находится в жидком состоянии, то при любых пропорциях входящих в него металлов оп представляет собой однородную смесь. При кристаллизации компоненты сплава могут образовать твердые растворы, химическне соединения, механические смеси. Твердыми растворами называются однородные твердые смеси, по своим свойствам сходные с жидкими смесями. Один металл может растворяться в другом или в любой пропорции, или до известного предела, называемого насыщенным. Атомы сплавов образуют общую кристаллическую решетку. При образовании кристаллов твердого раствора атомы растворяемого металла или внедряются в решетку между атомами растворителя, или замещают их в узлах кристаллических решеток. Иногда при образовании твердого раствора происходит одновременно и замещение, и внедрение атомов растворителей. Химические соединения происходят при строго определенной концентрации компонентов, образующих новый тип кристаллической решетки. Свойства химического соединения резко отличаются от свойств компонентов. Примером химического соединения является карбид железа РсзС. Если компоиеиты в твердом состоянии пе образуют ни твердый раствор, ни химическое соединение, то они будут находиться в состоянии механической смеси. При этом в сплаве будут кристаллические решетки обоих сплавов. Механическую смесь, например, образуют свинец и сурьма. § 5. ОСНОВНЫЕ ПОНЯТИЯ О ДИАГРАММЕ СОСТОЯНИЯ ЖЕЛЕЗОУГЛЕРОДИСТЫХ СПЛ.ЛВОВ Основными составляющими компонентами сталей и чугу1юв являются железо и углерод. Железо - серебристо-белый металл, имеющий температуру плавления 1539°С. Железо имеет различную кристаллическую структуру: при температуре от 1639°С до 1390°С и ниже 910°С железо имеет кубическую объемно-центрированную решетку и обозначается аРе; при температуре 1390°С железо имеет кубическую граие-цептрированную решетку. О диаграмме «железо - углерод» было известно уже в 1866 г., когда Д. К. Чернов указал на существование в железе критических точек. Критическими точками называются температуры, при которых сплав переходит из одного состояния в другое, например аРе переходит в уГс при 910°С (910°С - критическая точка). Диаграмма состояния показывает состояние сплава при любой температуре и любой концентрации и имеет большое теоретическое и практическое значение. Диаграмма состояния показывает, какие структуры образуются при кристаллизации сплавов и что происходит со сплавами в твердом состоянии при их нагревании и охлаждении. Диаграммы «железо - углерод» являются фупдамоп-том науки о стали и чугуне. Диаграммы состояния строят па основании кривых охлаждения. Для получения охлаждения расплавляют металл до жидкого состояния и в него помещают термопару для замера температуры. Затем металлу дают возможность медленно охлаждаться. При охлаждении замеряют температуру через определенные промежутки времени. Па основании полученных данных строят кривую охлаждения. На рис. 6 приведен график охлаждения чистого железа. График читается следующим образом. При застывании жидкого железа до =1539°С линия охлаждения 1539 1390  л.ц„ о с,,  «,3 6Ш с Рис. 6. График охлаждения чистого железа Рис. 7. Диаграмма состояния железоуглеродистых сплавов изменяется плавно. При f=1539°C па кривой образуется горизонтальный участок, показывающий температуру Затвердевания металла, при которой происходит процесс кристаллизаг[ии металла, сопровождающийся выделением тепла. Участок от 1539 до 1390°С указывает "а охлаждение. При температуро 1390°С на кривой снова появляется горизонтальная площадка, так как в течение перестройки кристаллической решетки аРе в vFe выделяется тепло. Перестройка кристаллической решетки vFe в немагнитное, а затем в .магнитное железо также происходит с выделением тепла (показано на графике горизонтальными участками при f = 9l(fC и t= = 768°С). Кривые охлаждения выводят для сплавов разной концентрации, а затем по этим кривым строят диаграмму состояния в координатах «температура - концентра-пня». Диаграмму состояний различных систем составляют для равновесных структур, поэтому на диаграмме Fe-FcaC все линии и точки даны для сплавов, находящихся в равповесно.м состоянии. Структура сплава называется равновесной, если скорость охлаждения настолько мала, что все процессы, которые долж/»ы совершаться в сплаве в период охлаждения, полностью закончились. Прежде чем изучить диаграмму Fe-РезС, рассмотрим, какие структуры образует железо с углеродом. К основным структурам относятся следующие. 1. Жидкий раствор углерода в расплавленном железе. 2. Феррит-твердый раствор углерода в аРе, технически чистое железо. В aFe может растворяться до 0,02% углерода. 3. Аустенит - твердый раствор углерода в yFe (при /=П30°С может раствориться до 2% углерода). Аустенит обладает высокой пластичностью и вязкостью. 4. Цементит-химическое соединение железа с углеродом. Имеет высокую твердость и низкую вязкость. 5. Перлит-механическая смесь, состоящая йз феррита и вторичного цементита. Перлит образуется при содержании углерода 0,87о при температуре 723°С. Пер лит является эвтектоидной смесью. 6. Ледебурит - механическая смесь, состоящая и; цементита и аустенита. Ледебурит образуется при со держании углерода 4,3% и температуре МЗОС. Леде бурит - эвтектическая смесь, т. е. легкоплавящаяся Эвтектический сплав имеет самую низкую температур; плавле1П1я из всех сплавов данной системы. Превращение из жидкого состояния в твердое (пер вичпая кристаллизация) происходит по линии АС1 (рис. 7), которая называется ликвидусом (но-латипск1 «жидкий»). Выше линии ACD сплавы системы находя гя п жидком состоянии (Ж). Линия АС указывает па то, что из жидкого раствора пачнпают выпадать кристаллы тпсрдпго раствора углерода в у-железе, т. е. аустенита (А). Таким образо.м, ниже линии АС находится смесь дв\х фаз -жидкого раствора и аустенита (Ж+.4). Окончательное затвердспапис стали выражено линией АЕС. Отсюда видно, что в отличие от чистого железа кристаллизация стали происходит не в одной точке, а в интервале температур. Например, для стали с содержанием 1,2% углерода разница между началом и концом затвердевания составляет около 250°С. Это имеет большое практическое значение, так как в процессе затвердевания стали вначале из жидкости выпадают кристаллы из наиболее чистого тугоплавкого сплава, а в конпе затвердевания идет кристаллизация более легкоплавкого загрязисиного при.мссями сплава, т. е. затвердевшая сталь получаст исодпородное кристаллическое строение. По линии CD из жидкого раствора выпадают кристаллы цементита (Я), поэтому в области CFD находится смесь ДВУХ фаз - жидкого раствора и цементита (Ж-\-Ц\). В точке С при содержании 4,3% и температуре 1130°С происходит одиовремснпо кристаллизация аустенита и пемептита и образуется топкая механическая смесь эвтектика, которая называется ледебуритом. Превращения в твердом состоянии (вторичная кристаллизация) выражены линией/l£CF, которую называют солидусом (по-латински «твердый»). Превращения в твердом веществе происходят вследствие перехода железа из одной модификации в другую при изменении Степени растворимости углерода в железе. На графике (см. рис. 7) область, ограниченная линиями AESO, является областью аустенита. При охлаждении сплавов аустенит распадается, выделяя феррит (Ф) (линия GS) и цементит (Цп) (линия SE), который выпадает из твердого раствора и называется избыточным, или вторичным в отличие от первичного пементита, выпадающего из жидкого раствора. В области диаграммы GSP находится смесь феррита и аустенита (Ф+Л), <т в области SEE] -смесь вторичного цементита п аусте-ггита. Расположение линии GS имеет болыпое практическое значение, так как оно характеризует температуру нагрева при различных видах термической обработки стали с содержанием углерода ниже 0,8%. При охлаж-лении стали с содержанием от О до 0,8% по линии GS |
|
© 2007 RCSZ-TCC
Телеком оборудование Поддержка сайта: rcsz-tcc.ru@r01-service.ru +7(495)795-01-39, номер 607919 |